Att fasta två gånger 48 timmar var lika effektivt mot cancer som två cykler cellgifter – vid bröstcancer, melanom och neuroblastom, berättar läkaren John Soo. Och att vattenfasta två dagar per vecka minskade tumörtillväxt och metastaser.
Och ja, allt fler studier visar stor effekt av fasta vid cancer. Fastan främjar effekter som begränsar cancercellers anpassningsförmåga, överlevnad och tillväxt. Fasta har framför allt visats öka effektiviteten av cancerbehandlingar och begränsa biverkningar.
Cancer kännetecknas av okontrollerad tillväxt av avvikande celler. Det drabbar årligen över 19 miljoner människor och orsakar nästan 10 miljoner dödsfall. Men de behandlingsmetoder som används är långt ifrån tillfredsställande. Inte minst pga deras allvarliga biverkningar som skadar även friska celler. Det är därför av största vikt att lyfta fram de mekanismer som kännetecknar cancerceller och hur man kan komma åt dem även med hjälp av livsstilsfaktorer. I podcastavsnitt 362 pratar jag om detta, och om 20 saker som enligt forskning har effekt mot cancer. I detta inlägg lyfter jag en av sakerna – fasta. Lyssna på övriga 19 i avsnitt 362.
Notera att det oftast är kombinationen av livsstilsfaktorer och konventionell behandling som ger störst effekt.
Fasta skyddar friska celler och skadar cancerceller
Som jag tar upp i avsnitt 362 så är fördelen med fasta att den selektivt skadar cancerceller. Detta beror på cancercellers sårbarheter. Man kan se det som att friska celler ligger vilande under en fasta, och stärker sitt försvar. Men cancerceller är redan skadade celler, så de kämpar för att överleva under fasta.
Fasta kan hjälpa till att förebygga cancer. Och i kombination med konventionell cancerbehandling kan fasta hjälpa till att stoppa sjukdomsprogressionen även för de mest aggressiva tumörerna, samtidigt som fasta minskar belastning och skada på kroppens friska celler.
Vad händer under fasta?
Under fasta sjunker blodsockret och därmed insulinnivåerna. Samtidigt stiger glukagonnivåerna. Detta ökar nedbrytningen av leverglykogenreserver (till glukos) och triglycerider (till glycerol och fria fettsyror). De flesta vävnader använder då fettsyror för energi, medan hjärnan anpassar sig och allt mer använder ketonkroppar (utöver glukos) som energi.
Glukoneogenes, dvs nybildning av glukos (blodsocker) från glycerol (från fett) och aminosyror ökar för att kunna hålla blodsockret stabilt. Detta blodsocker används i det fastande tillståndet i huvudsak av hjärnan.
Vilka cancermekanismer påverkas av fasta?
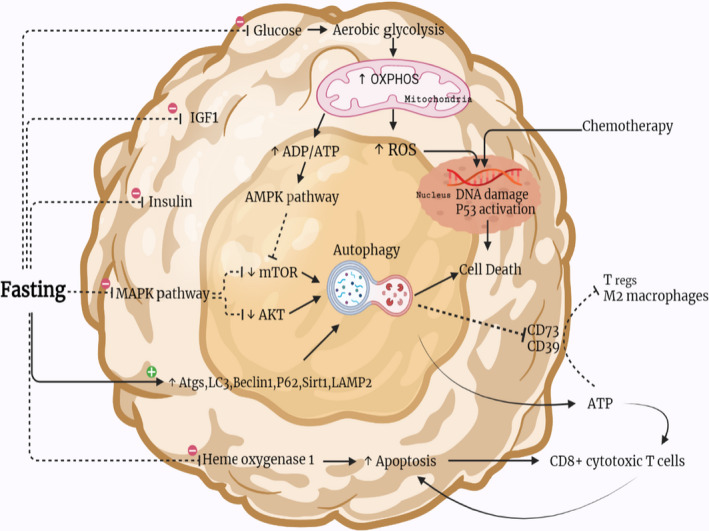
Fasta gör att bl.a. glukos, IGF1 (Insulin‐like growth factor 1) och insulin sjunker. Detta minskar bränsle till cancerceller och det minskar tillväxtstimulering.
En av de viktigaste skillnaderna mellan cancer och normala celler är att cancerceller har ett mycket högre glukosupptag än friska celler. Om vi begränsar cirkulerande glukos (blodsocker) kan friska celler byta till alternativa bränslekällor – fettsyror och ketoner. Cancerceller har inte förmågan att göra samma metaboliska växling.
Att IGF1 (och även insulin) minskar och nedregleras är en av de grundläggande mekanismerna vid fasta för att främja kemoterapitolerans och minimera negativa biverkningar. Det gör alltså att man får mindre biverkningar av cellgifter. Höga IGF-1-nivåer å andra sidan minskar apoptos, celldöd, ökar celldelning/spridning och ökar genetisk instabilitet, vilket gynnar cancer. Detta har man framförallt sett i tjocktarmscancer, prostatacancer och bröstcancer. Så när fasta minskar IGF1-aktivitet, så minskar risken för, och tillväxten av, cancer bl.a. genom mer apoptos/celldöd och mindre tillväxt.
FGF21 (Insulin‐like growth factor‐binding protein 1) ökar under fasta, och det spelar en viktig roll för att sänka IGF1-nivåerna och hämmar IGF1 från att interagera med cellernas receptorer, vilket begränsar aktiviteten av IGF1.
Även MAPK-aktivitet minskar (reglerar det som händer i cellerna som svar på vad som händer i omgivningen).
Samtidigt ökar autofagireglerande komponenter (Atgs, LC3, Beclin1, p62, Sirt1 och LAMP2). Autofagi handlar ju om att cellerna börjar bryta ner proteiner, för att kunna återanvända dem eller producera bränsle – och då är det framförallt skadade proteiner som bryts ner. SirT1 och andra sirtuiner ändrar cellernas beteende, bl.a. leder det till minskad inflammation och ökad cellreparation.
När fasta aktiverar autofagiprocessen i cancerceller, inducerar det celldöd, apoptos, genom en mängd olika mekanismer. Det undertrycker CD73- och CD39, orsakar extracellulär ATP-ackumulering, vilket hämmar Treg-celler och M2-fenotypen av makrofager, samtidigt som det aktiverar CD8+ cytotoxiska T-celler (mer om immunförsvarets celler i podcastasvnitt 279-281). Fasta hämmar också hemoxygenas 1. Detta påskyndar celldöd och aktiverar CD8+ cytotoxiska T-lymfocyter, som driver apoptoscykeln igen.
Fasta gör att cancerceller frisätter oxidativ fosforylering (OXPHOS) genom aerob glykolys, vilket leder till en ökning av reaktiva syrearter (ROS, dvs fria radikaler), p53-aktivering (tumörsuppressorgen) DNA-skada och celldöd som svar på kemoterapi, cellgifter. Cellgifterna blir alltså mer effektiva vid fasta eftersom cancercellerna är mycket mer sårbara.
Histondeacetylaser hämmas av ketonkroppar, vilket kan bromsa tumörutvecklingen. Och β-hydroxibutyrat, en ketonkropp, fungerar som en endogen histondeacetylashämmare. Denna hämmar signalerna, vilket skyddar kroppen från oxidativ stress. Allt det här handlar om epigenetik, dvs vilka gener som är på eller avslagna. Det är mycket fokus på utvecklingen av cancerläkemedel som påverkar just histondeacetylaser för att behandla svårbehandlade cancerformer. Men ketonerna som bildas vid fasta stimulerar alltså detta förlopp naturligt.
Fasta höjer också adiponektin (hormon som är känt för att minska inflammation och öka insulinkänslighet och fettförbränning) och förändrar mTOR-signalvägen. Dessa effekter är kända för att påverka canceretiologi, vilket resulterar i antitumöreffekter, minskad produktion av fria radikaler och ökad resistens mot stress.
Fasta för att förebygga cancer?
Fasta kan minska cancerrisken. Kaloribegränsning, som är en av fastans effekter, visar sig i studier gång på gång minska cancer. Bl.a. har man sett 50 % minskning av spontan cancerincidens hos apor. Mänskliga försök har visat liknande resultat.
Och mekanismerna beskrivna ovan ger förklaringar till varför fasta kan förebygga cancer.
De förebyggande effekterna med fasta (och/eller kaloribegränsad kost) på cancer beror på flera sammankopplade processer. Kroppen gör stora metabola och hormonella anpassningar, inklusive lägre insulinnivåer och ökad insulinkänslighet, högre nivåer av IGFBP1 (dvs lägre IGF1) och SHBG (sex hormone binding globulin), lägre nivåer av östrogen och lägre oxidativa och inflammatoriska processer. Det stimulerar reparation av DNA, autofagi, antioxidanteffekt mm, samtidigt som det minskar celltillväxt mm.
Fasta vid cancer och cancerbehandling?
Fasta i mer än en dag regelbundet kan skydda friska normala celler från toxiciteten av kemoterapi (cellgifter) och strålning. Cancerceller, men inte friska normala omgivande celler, förhindras från att omvandlas till ett stresståligt tillstånd vid fasta.
Fasta kan skydda normal vävnad mot de skadliga biverkningarna av cellgifter, samtidigt som det förbättrar resultatet av behandlingen på cancerceller. Detta med hjälp av en process som kallas differentiell stressrespons.
Dessutom har cancerceller en avvikande metabolisk aktivitet, som huvudsakligen är baserad på glykolys, vilket resulterar i större glukosabsorption och glukosnedbrytning till laktat, ett fenomen som kallas Warburg-effekten. Som ett resultat kan glukosbrist göra cancerceller mer känsliga för de skadliga effekterna av cellgifter och öka apoptos, celldöd. Detta visas i studierna vid längre fasta och ketogen kost.
En minskning av IGF-1 på grund av förlängd fasta ökar cancercellers känslighet för kemoterapi. Längre fasta ledde till låga insulin- och IGF-1-nivåer, och en minskning av biverkningar som huvudvärk, svaghet och stomatit.
Dessutom, under perioderna av fasta vid behandling, sänktes den totala toxicitetspoängen (toxicity score ) drastiskt och det blev mycket färre behandlingsförseningar, dvs behandlingarna kunde fortgå utan eventuella uppehåll pga biverkningar.
En del läkare är rädda för att fastan ska ge allvarlig viktminskning och näringsbrist. At den ska utlösa undernäring, sarkopeni och kakexi. I de hittills publicerade kliniska studierna av fasta i samband med kemoterapeutiska läkemedel har dock inga fall av allvarlig viktminskning eller undernäring dokumenterats med signifikant effekt.
I podcastavsnitt 272 pratar vi om hur man kan lägga upp fastan och gärna fasta inför och under själva behandlingen.
Fler råd mot cancer
Lyssna på alla 20 saker mot cancer i podcastavsnitt 362















Senaste kommentarer