 Populärast i juli var inlägget om jodbristens följder
Populärast i juli var inlägget om jodbristens följder
https://4health.se/om-mineralet-jod-och-jodbristens-koppling-till-pcos-fibromyalgi-cancer-mm- Om följderna av mitt eget barns livsstil
https://4health.se/samband - Om träningstekniken slowburn och varför jag inte använder mig av den
https://4health.se/darfor-kor-jag-inte-slowburn - Om magflora och vikt
https://4health.se/hur-magfloran-paverkar-din-vikt-och-vad-du-kan-gora - Så fungerar kroppen: Om mTOR och protein
https://4health.se/minska-protein-del-2-om-amnesomsattningsprocesser-och-cancer - Olika sorters mättat fett
https://4health.se/skillnader-mellan-olika-sorters-mattat-fett - Hur beteendet styrs av vikt och hormoner
https://4health.se/sa-fungerar-kroppen-sa-andras-ditt-beteende-med-dina-hormonnivaer-och-darfor-blir-man-fet-av-hjarntumorer
Search Results for: mTOR
Minska protein del 2 – om mTOR, ämnesomsättningsprocesser och cancer
 Jag skrev en populär del 1 här: https://4health.se/minska-pa-proteinet
Jag skrev en populär del 1 här: https://4health.se/minska-pa-proteinet
Idag ska jag kortfattat skriva om en spännande grej som kallas mTOR, mammalian target of rapamycin. mTOR kan man nog lättast beskriva som en del av en ämnesomsättningsprocess, engelskans signalling pathway är dock mer korrekt. mTOR reglerar bl.a. celltillväxt och proteinsyntes. Namnet mTOR kan referera till genen mTOR eller till proteinet mTOR som genen styr.
Vid sidan av insulin/blodsocker och dess enorma påverkan på vår hälsa som vid det här laget är ganska välkänd, har mTOR visat sig påverka bl.a. fortplantningsförmåga, åldrande och risk för degeneration sjukdomar och cancer.
Anledningen att kalorirestriktion visat sig så hälsosam i flertalet studier beror ju till stor del på att man då minskar blodsocker och insulinnivåer. Dvs en effekt vi kan uppnå genom kolhydratbegränsning. Men en ytterligare anledning till att kalorirestriktion är hälsosam är dess påverkan på mTOR genom ett begränsat intag av protein.
mTOR verkar fungera som ett slags sensor för proteinintag och tillhör en större “pathway” som kallas P13K. P13K aktiveras bl.a. av insulin, men också av andra tillväxtfaktorer.
mTOR integrerar input som insulin, tillväxtfaktorer som IGF-1 och IGF-2 och aminosyror (dvs protein). Det känner också av cellernas näringsnivå, syre och energinivåer.
Man vet att mTOR är ur normaltillstånd vid sjukdomar såsom diabetes och vissa cancerformer.
Att hålla mTOR nedreglerad genom att begränsa proteinintaget (inte minimera, utan ett moderat proteinintag) – den uppregleras ju bl.a. av aminosyror – är en nyckel för att maximera kroppens underhåll, immunfunktion mm. Vilket kan förlänga livslängden och minska åldrandeprocessen. Särskilt om man gör detta vid sidan av att minimera insulinpåslaget.
Lösningen är alltså en kost som är rik på fett, men fattig på kolhydrater och som har ett begränsat/ moderat proteininnehåll.
Det är dock så att mTOR spelar en stor roll för tillväxt och fortplantning, så när man försöker bli med barn eller rent av är gravid, eller om man har ett mycket tungt arbete så behöver man större mängder protein och ska inte vara alltför försiktig.
http://www.primalbody-primalmind.com/protein-how-much-is-too-much/
Fasta lika effektivt som cellgifter – ännu effektivare i kombination
Att fasta två gånger 48 timmar var lika effektivt mot cancer som två cykler cellgifter – vid bröstcancer, melanom och neuroblastom, berättar läkaren John Soo. Och att vattenfasta två dagar per vecka minskade tumörtillväxt och metastaser.
Och ja, allt fler studier visar stor effekt av fasta vid cancer. Fastan främjar effekter som begränsar cancercellers anpassningsförmåga, överlevnad och tillväxt. Fasta har framför allt visats öka effektiviteten av cancerbehandlingar och begränsa biverkningar.
Cancer kännetecknas av okontrollerad tillväxt av avvikande celler. Det drabbar årligen över 19 miljoner människor och orsakar nästan 10 miljoner dödsfall. Men de behandlingsmetoder som används är långt ifrån tillfredsställande. Inte minst pga deras allvarliga biverkningar som skadar även friska celler. Det är därför av största vikt att lyfta fram de mekanismer som kännetecknar cancerceller och hur man kan komma åt dem även med hjälp av livsstilsfaktorer. I podcastavsnitt 362 pratar jag om detta, och om 20 saker som enligt forskning har effekt mot cancer. I detta inlägg lyfter jag en av sakerna – fasta. Lyssna på övriga 19 i avsnitt 362.
Notera att det oftast är kombinationen av livsstilsfaktorer och konventionell behandling som ger störst effekt.
Fasta skyddar friska celler och skadar cancerceller
Som jag tar upp i avsnitt 362 så är fördelen med fasta att den selektivt skadar cancerceller. Detta beror på cancercellers sårbarheter. Man kan se det som att friska celler ligger vilande under en fasta, och stärker sitt försvar. Men cancerceller är redan skadade celler, så de kämpar för att överleva under fasta.
Fasta kan hjälpa till att förebygga cancer. Och i kombination med konventionell cancerbehandling kan fasta hjälpa till att stoppa sjukdomsprogressionen även för de mest aggressiva tumörerna, samtidigt som fasta minskar belastning och skada på kroppens friska celler.
Vad händer under fasta?
Under fasta sjunker blodsockret och därmed insulinnivåerna. Samtidigt stiger glukagonnivåerna. Detta ökar nedbrytningen av leverglykogenreserver (till glukos) och triglycerider (till glycerol och fria fettsyror). De flesta vävnader använder då fettsyror för energi, medan hjärnan anpassar sig och allt mer använder ketonkroppar (utöver glukos) som energi.
Glukoneogenes, dvs nybildning av glukos (blodsocker) från glycerol (från fett) och aminosyror ökar för att kunna hålla blodsockret stabilt. Detta blodsocker används i det fastande tillståndet i huvudsak av hjärnan.
Vilka cancermekanismer påverkas av fasta?
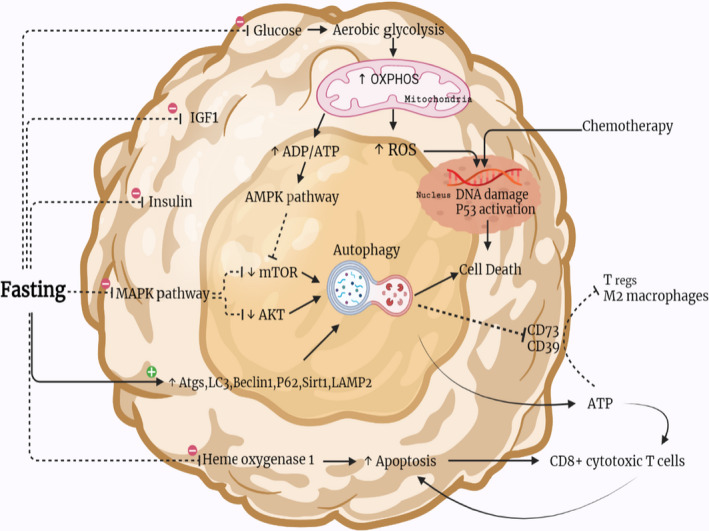
Fasta gör att bl.a. glukos, IGF1 (Insulin‐like growth factor 1) och insulin sjunker. Detta minskar bränsle till cancerceller och det minskar tillväxtstimulering.
En av de viktigaste skillnaderna mellan cancer och normala celler är att cancerceller har ett mycket högre glukosupptag än friska celler. Om vi begränsar cirkulerande glukos (blodsocker) kan friska celler byta till alternativa bränslekällor – fettsyror och ketoner. Cancerceller har inte förmågan att göra samma metaboliska växling.
Att IGF1 (och även insulin) minskar och nedregleras är en av de grundläggande mekanismerna vid fasta för att främja kemoterapitolerans och minimera negativa biverkningar. Det gör alltså att man får mindre biverkningar av cellgifter. Höga IGF-1-nivåer å andra sidan minskar apoptos, celldöd, ökar celldelning/spridning och ökar genetisk instabilitet, vilket gynnar cancer. Detta har man framförallt sett i tjocktarmscancer, prostatacancer och bröstcancer. Så när fasta minskar IGF1-aktivitet, så minskar risken för, och tillväxten av, cancer bl.a. genom mer apoptos/celldöd och mindre tillväxt.
FGF21 (Insulin‐like growth factor‐binding protein 1) ökar under fasta, och det spelar en viktig roll för att sänka IGF1-nivåerna och hämmar IGF1 från att interagera med cellernas receptorer, vilket begränsar aktiviteten av IGF1.
Även MAPK-aktivitet minskar (reglerar det som händer i cellerna som svar på vad som händer i omgivningen).
Samtidigt ökar autofagireglerande komponenter (Atgs, LC3, Beclin1, p62, Sirt1 och LAMP2). Autofagi handlar ju om att cellerna börjar bryta ner proteiner, för att kunna återanvända dem eller producera bränsle – och då är det framförallt skadade proteiner som bryts ner. SirT1 och andra sirtuiner ändrar cellernas beteende, bl.a. leder det till minskad inflammation och ökad cellreparation.
När fasta aktiverar autofagiprocessen i cancerceller, inducerar det celldöd, apoptos, genom en mängd olika mekanismer. Det undertrycker CD73- och CD39, orsakar extracellulär ATP-ackumulering, vilket hämmar Treg-celler och M2-fenotypen av makrofager, samtidigt som det aktiverar CD8+ cytotoxiska T-celler (mer om immunförsvarets celler i podcastasvnitt 279-281). Fasta hämmar också hemoxygenas 1. Detta påskyndar celldöd och aktiverar CD8+ cytotoxiska T-lymfocyter, som driver apoptoscykeln igen.
Fasta gör att cancerceller frisätter oxidativ fosforylering (OXPHOS) genom aerob glykolys, vilket leder till en ökning av reaktiva syrearter (ROS, dvs fria radikaler), p53-aktivering (tumörsuppressorgen) DNA-skada och celldöd som svar på kemoterapi, cellgifter. Cellgifterna blir alltså mer effektiva vid fasta eftersom cancercellerna är mycket mer sårbara.
Histondeacetylaser hämmas av ketonkroppar, vilket kan bromsa tumörutvecklingen. Och β-hydroxibutyrat, en ketonkropp, fungerar som en endogen histondeacetylashämmare. Denna hämmar signalerna, vilket skyddar kroppen från oxidativ stress. Allt det här handlar om epigenetik, dvs vilka gener som är på eller avslagna. Det är mycket fokus på utvecklingen av cancerläkemedel som påverkar just histondeacetylaser för att behandla svårbehandlade cancerformer. Men ketonerna som bildas vid fasta stimulerar alltså detta förlopp naturligt.
Fasta höjer också adiponektin (hormon som är känt för att minska inflammation och öka insulinkänslighet och fettförbränning) och förändrar mTOR-signalvägen. Dessa effekter är kända för att påverka canceretiologi, vilket resulterar i antitumöreffekter, minskad produktion av fria radikaler och ökad resistens mot stress.
Fasta för att förebygga cancer?
Fasta kan minska cancerrisken. Kaloribegränsning, som är en av fastans effekter, visar sig i studier gång på gång minska cancer. Bl.a. har man sett 50 % minskning av spontan cancerincidens hos apor. Mänskliga försök har visat liknande resultat.
Och mekanismerna beskrivna ovan ger förklaringar till varför fasta kan förebygga cancer.
De förebyggande effekterna med fasta (och/eller kaloribegränsad kost) på cancer beror på flera sammankopplade processer. Kroppen gör stora metabola och hormonella anpassningar, inklusive lägre insulinnivåer och ökad insulinkänslighet, högre nivåer av IGFBP1 (dvs lägre IGF1) och SHBG (sex hormone binding globulin), lägre nivåer av östrogen och lägre oxidativa och inflammatoriska processer. Det stimulerar reparation av DNA, autofagi, antioxidanteffekt mm, samtidigt som det minskar celltillväxt mm.
Fasta vid cancer och cancerbehandling?
Fasta i mer än en dag regelbundet kan skydda friska normala celler från toxiciteten av kemoterapi (cellgifter) och strålning. Cancerceller, men inte friska normala omgivande celler, förhindras från att omvandlas till ett stresståligt tillstånd vid fasta.
Fasta kan skydda normal vävnad mot de skadliga biverkningarna av cellgifter, samtidigt som det förbättrar resultatet av behandlingen på cancerceller. Detta med hjälp av en process som kallas differentiell stressrespons.
Dessutom har cancerceller en avvikande metabolisk aktivitet, som huvudsakligen är baserad på glykolys, vilket resulterar i större glukosabsorption och glukosnedbrytning till laktat, ett fenomen som kallas Warburg-effekten. Som ett resultat kan glukosbrist göra cancerceller mer känsliga för de skadliga effekterna av cellgifter och öka apoptos, celldöd. Detta visas i studierna vid längre fasta och ketogen kost.
En minskning av IGF-1 på grund av förlängd fasta ökar cancercellers känslighet för kemoterapi. Längre fasta ledde till låga insulin- och IGF-1-nivåer, och en minskning av biverkningar som huvudvärk, svaghet och stomatit.
Dessutom, under perioderna av fasta vid behandling, sänktes den totala toxicitetspoängen (toxicity score ) drastiskt och det blev mycket färre behandlingsförseningar, dvs behandlingarna kunde fortgå utan eventuella uppehåll pga biverkningar.
En del läkare är rädda för att fastan ska ge allvarlig viktminskning och näringsbrist. At den ska utlösa undernäring, sarkopeni och kakexi. I de hittills publicerade kliniska studierna av fasta i samband med kemoterapeutiska läkemedel har dock inga fall av allvarlig viktminskning eller undernäring dokumenterats med signifikant effekt.
I podcastavsnitt 272 pratar vi om hur man kan lägga upp fastan och gärna fasta inför och under själva behandlingen.
Fler råd mot cancer
Lyssna på alla 20 saker mot cancer i podcastavsnitt 362
Därför skyddar träning mot cancer – så funkar det i kroppen

Träning förebygger cancer och återfall i cancer har flera studier pekat på, men mekanismen bakom har till stor del varit okänd. Ny forskning visar vad som faktiskt händer i kroppen.
Det man ser är att träning leder till metabolisk “omprogrammering” av inre organ. Denna omprogrammering ökar näringsbehovet och skyddar mot metastaser (celler som sprider sig från cancertumören till andra delar av kroppen) genom att begränsa näringstillgängligheten för tumören.
Forskarna pratar om att träning genererar en metabolisk sköld. Detta är intressant eftersom det är just så forskaren Valter Longo (känd för forskning på fasta och FMD, fasting mimicking diet) beskriver effekten av fasta på friska celler vs. cancerceller. Dvs de friska cellerna får en sköld, ett skydd, av fasta; vilket bl.a. kan skydda de friska cellerna vid cellgiftsbehandling och strålning (med följd att bl.a. biverkningar minskar). Medan cancercellerna försvagas av fasta och blir mer känsliga för cancerbehandlingen. Läs mer i inläggen här: https://4health.se/?s=longo
Jag brukar ofta likna fasta och träning vid varandra. De är båda hälsosamma påfrestningar för vår kropp, som friska celler kan bli starkare av, medan sjuka celler / cancerceller försvagas.
Några av sakerna man ser:
- Metaboliska kapacitetsanalyser av inre organ visade att träning sätter igång katabola processer, glukosupptag, mitokondriell aktivitet och GLUT-uttryck. Du behöver inte förstå dessa sista begrepp exakt, men allt har att göra med metabolismen, dvs ämnesomsättningen, på cellnivå.
- Analys av plasma visade ökat kolhydratutnyttjande efter träning.
- Epidemiologiska data från en 20-årig studie av en stor grupp människor som initialt var cancerfria, visade att träning före cancerstarten framförallt minskade sannolikheten för metastaserande cancer. Och i tre olika modeller av melanom hos möss skyddade träning före cancer avsevärt mot metastaser.
- De skyddande effekterna av träning var kopplade till mTOR-aktivitet. Vad mTOR är kan du läsa om i tidigare inlägg här: https://4health.se/?s=mTOR och kanske framförallt detta: https://4health.se/minska-protein-del-2-om-amnesomsattningsprocesser-och-cancer
- Aktivt stroma (stödstrukturen/bindvävsdelen i organen) förbrukade betydligt mer glukos på bekostnad av tumören. Sammantaget tyder dessa data på en konflikt mellan cancerns metaboliska plasticitet/ anpassningsförmåga, och träningsinducerad metabolisk omprogrammering av stroma, vilket ger en möjlighet att blockera metastaser genom att utmana tumörens metaboliska behov.
- Klassiska kännetecken för cancer, inklusive immunsvar, tumörvaskulatur (blodkärl), hypoxi, pH och autofagi kan alla påverkas av träning och därmed bidra till att ytterligare skapa en tumörfientlig mikromiljö.
- Glukoskonsumtion (blodsocker) hos cancerceller har visat sig metaboliskt begränsa T-cellsaktivitet (immunförsvaret alltså, mer om dessa olika immunceller i avsnitt 279-281 https://4health.se/279-immunforsvaret-sa-funkar-det-del-1-det-ospecifika-medfodda-immunforsvaret) i mikromiljön runt tumören. Man kan säga att tumören stjäl blodsockret från immuncellerna i dess närhet, så att immuncellerna får för lite energi. I forskningen såg man dock tecken på att träning stimulerar metabolismen i immuncellerna i tumörens mikromiljö, och därför skulle träning kunna förbättra immunförsvaret mot cancer. Även detta var kopplat till metabolismen i stroma, dvs stödstrukturen i organen.
Träning skyddar alltså mot cancertillväxt och metastaser genom att inducera ett högt näringsbehov i inre organ. Detta indikerar också att en minskning av näringstillgängligheten för tumörceller är en möjlig strategi för att förhindra metastaser. Helt i linje med det vi pratar om bl.a. i podcastavsnitt 272 – där vi fokuserar på hur kostupplägg och fasta kan få just dessa effekter: https://4health.se/272-bekampa-cancer-ida-johnssons-resa-fran-stadium-iv-cancer
Forskarna kommenterar klokt att det krävs mer (både forskning och annat mot cancer) – olympiska och professionella idrottare är ju inte immuna mot att utveckla cancer.
Men träning i kombination med sådant vi pratar om i poddar (avsnitt 272, 92, 92b samt 40) ang kost, fasta mm mot cancer kan vara en nyckel.
Personligen tror jag att det är viktigt med rätt sorts träning. Monoton och långvarig konditionsträning höjer ju kortisol och därmed blodsocker, vilket kan vara negativt vid cancer, särkilt när man försöker bekämpa cancern med ketogen kost och fasta (cancercellerna lever på denna glukos). Däremot kan tyngre och mer uppbyggande träning stimulera metabolismen utan att behöva höja blodsockret så som typisk cardio-träning.
Forskning: 10 växter mot cancer
Cancer är den näst vanligaste dödsorsaken efter hjärt- och kärlsjukdomar. Men behandling är inte alltid effektiv och dessutom förknippad med allvarliga biverkningar. Det finns sätt att minimera biverkningar, bl.a. mha fasta i samband med själva behandlingarna, vilket vi bl.a. pratar om i podcast 272 https://4health.se/272-bekampa-cancer-ida-johnssons-resa-fran-stadium-iv-cancer och som du även kan läsa om i tidigare inlägg här: https://4health.se/?s=fasta+biverkningar+cancer
En ny vetenskaplig artikel poängterar att växtbaserade naturliga produkter kan vara både effektivare och ge mindre biverkningar, och att man bör titta vidare på hur man utformar effektivare kombinationsbehandlingar mot cancer med naturliga produkter. Man betonar i artikeln hur man bör rikta sig mot de särskilda egenskaper som just cancerceller utvecklar, och man tittar närmare på tio växter som jag skriver mer om i det här inlägget.
Cancer Hallmarks, särskilda egenskaper hos cancerceller
I artikeln skriver man om så kallade “cancer hallmarks” som är särskilda kännetecken för cancerceller och förenklat kan sägas vara särskilda egenskaper som cancerceller utvecklar (som inte friska celler gör), såsom genetisk instabilitet, bibehållen tillväxtsignalering, receptorer för IGF-1 mfl tillväxtfaktorer, dämpad aopoptos (undvikande av programmerad celldöd), oreglerad metabolism och ökad blodkärlsbildning – se bild här och även punktlistor med mer detaljer längst ner i inlägget.
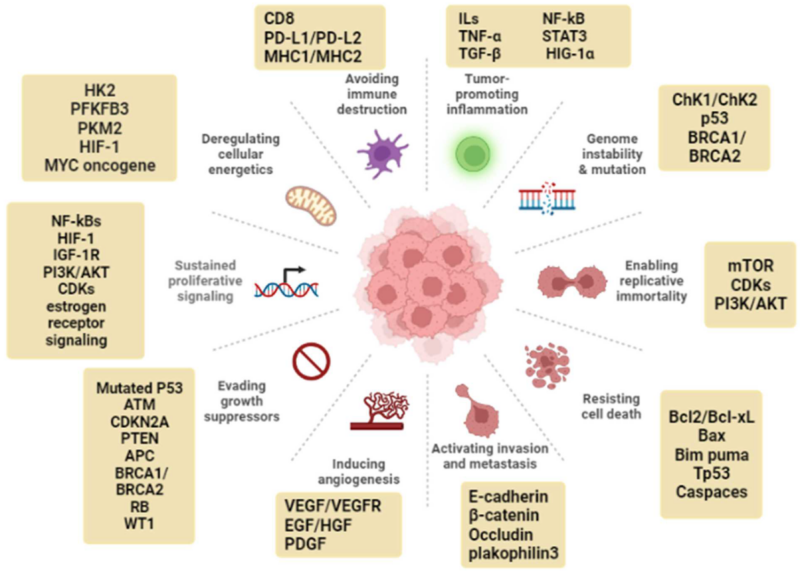
Växtämnen mot cancer
På nästa bild kan vi se hur specifika växtämnen – många av dem har jag skrivit om tidigare här på bloggen, och pratat om i podcasten – är effektiva mot vart och ett av dessa cancer hallmarks. Ämnena inkluderar tex allicin från vitlök, resveratrol som är det mörka färgämnet i bär och druvor, kurkumin i gurkmeja, quercetin som bl.a. finns i lök och äpple mm.
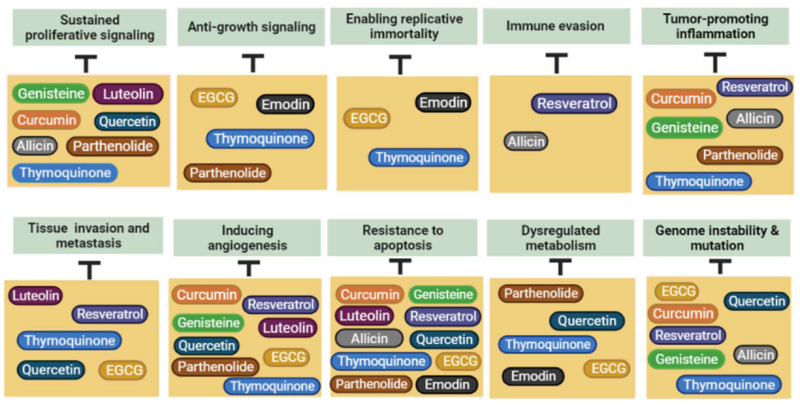
Följande tio växtämnen har tydliga egenskaper som kan användas mot dessa canceregenskaper
1. Kurkumin (gurkmeja)
Kurkumin eller curcumin i gurkmeja har traditionellt använts i asiatiska länder som en medicinsk ört på grund av dess många hälsofördelar. Kurkumin är antiinflammatorisk, antioxidant, antibakteriell, antiviral, antidiabetisk, ökar sårläkningsförmåga samt har anticancer- och kemopreventiv aktivitet.
När det gäller dess aktivitet mot just cancer så kan man se följande i forskningen:
- Curcumin har visat sig hämma cancer i prekliniska studier utförda på bl.a. prostata-, bukspottkörtel-, ovarie-, oral epitelial leukemi, lever-, bröst-, livmoderhalscancer, mag- och koloncancer. Flera mekanismer har föreslagits för att förklara de lovande resultaten av curcumin vid cancerbehandling.
- En av de viktigaste mekanismerna för curcumins anticancereffekter är dess antioxidantegenskaper, eftersom det kan öka serumkoncentrationen av antioxidanter som superoxiddismutas (SOD), glutationperoxidas (GPx) och lipidperoxider.
- Dessutom fungerar curcumin också som ett bra rensningsmedel för olika former av fria radikaler, såsom reaktivt syre (ROS) och reaktiva kvävearter (RNS), och hämmar ROS-genererande enzymer såsom lipoxygenas/cyklooxygenas och xantinhydrogenas/oxidas.
- Curcumin kan modulera flera signalvägar associerade med cancertillväxt, såsom undertryckande av angiogenes (blodkärlsbildning) och induktion av apoptos (celldöd).
- Curcumins anticancereffekt kan också utövas via nedreglering av pyruvatkinas M2 (PKM2), vilket minskar laktatproduktionen och upptaget av glukos i cancerceller [93].
- Curcumin kan också inducera cellcykelstopp vid G2/M-fasen, förmodligen genom att minska uttrycket av CDC2 och CDC25, och öka P21-uttrycket .
- Dessutom har curcumin påverkat den cellulära utvecklingen i icke-småcellig lungcancer och stimulerat G0/G1-fasstopp via MTA1 (metastasassocierat protein 1)-medierad deaktivering av Wnt/β-catenin-vägen [96].
- Flera studier tyder också på att curcumin utövar sina anticanceregenskaper genom att rikta in sig på olika mikroRNA (miRNA) uttryck. miRNA spelar en avgörande roll i olika fysiologiska tillstånd, inklusive differentiering, tillväxt, angiogenes och apoptos.
- Den synergistiska rollen av curcumin i kombination med andra kemoterapeutiska medel har också rapporterats, en effekt som leder till ökad effektivitet och minskade toxiska effekter av dessa läkemedel .
- Curcumin har visats vända cancercellers resistens mot cancerläkemedel.
- Curcumin visar ingen toxicitetseffekt på normala celler. En fas I-studie på människor med 25 patienter som tog upp till 8000 mg curcumin per dag i tre månader upptäckte ingen skada av curcumin. Fem ytterligare humana studier med användning av 1125–2500 mg curcumin per dag visade att det var säkert.
2. Resveratrol (mörka bär och druvor)
Resveratrol är en polyfenolförening i växter och hittas i bl.a. mullbär, jordnötter, tranbär, blåbär och vindruvor. Studier har visat att resveratrol uppvisar många olika hälsofrämjande egenskaper, inklusive antioxidanta, antiinflammatoriska, kardiovaskulärt skyddande, anti-aging och anticanceregenskaper.
- Resveratrol kan agera som en renare av ett antal fria radikaler. Dessutom ökar resveratrol uttrycket av olika antioxidantenzymer, såsom SOD, katalas (CAT), glutationreduktas (GS-R), (GPx) och glutation S-transferas (GST). Således skyddar resveratrol, genom dessa två antioxidanteffekter, celler från oxidativ skada.
- Omvänt, som kemoterapeutika, kan resveratrol i kombination med As2O3 förbättra apoptosinducerande oxidativ stress via induktion av ROS [119].
- En annan möjlig anticancermekanism för resveratrol är relaterad till kinaser, som spelar en avgörande roll i celltillväxt och proliferation och vanligtvis överuttrycks i många tumörer. Resveratrol riktar sig specifikt mot många kinaser, inklusive EGF, extracellulära signalreglerade kinaser (ERK) och VEGF, vilket minskar deras uttryck och resulterar i anti-tillväxtsignalaktivitet.
- Resveratrols anticanceraktivitet är också relaterad till dess antiinflammatoriska aktivitet, eftersom flera typer av cancer i viss utsträckning främjas av en viss grad av systemisk, låggradig kronisk inflammation. Resveratrol undertrycker den inflammatoriska biomarkören tumörnekrosfaktor α (TNF-α-)-inducerad signalering, bl.a. via nukleär faktor kappa-B (NFκB) aktivering
- I tjocktarmscancer, uppmuntrade resveratrol cellcykelstopp.
- Resveratrolbehandling ökade p27- och p21-genexpressionsnivåer, samt sänkte cyklin B-genexpression.
- Dessutom finns betydande bevis på att resveratrol kan inducera apoptos (celldöd) i en mängd olika cancerceller, även om den underliggande mekanismen skiljer sig mycket mellan olika cancercelltyper
- resveratrol kan hämma metastaser via flera olika processer.
- Nyligen genomförda studier antydde att resveratrols antitumöreffekter också kan medieras genom att stärka antitumörimmuniteten och vända den immunsuppressiva tumörmikromiljön, som etableras genom stimulering av cytokiner/kemokinutsöndring och uttryck av flera andra immunrelaterade gener.
- liksom många andra fytokemikalier visar resveratrol en synergistisk hämmande effekt på proliferationen av olika cancerceller och ökar deras kemokänslighet mot många kemoterapeutiska medel
- trots den höga cytotoxiciteten hos resveratrol mot tumörceller, verkar det vara väl tolererat utan någon signifikant skada registrerad mot normala celler
3. Quercetin (lök och äpple)
Quercetin är en flavonoid. Flavonoider finns huvudsakligen i växters frön, bark, löv och blommor. Flavonoider är kategoriserade i sex klasser och quercetin faller under underklassen flavonoler.
Quercetin finns i många livsmedel som kapris, äpplen, bär, brassica grönsaker (kål mm), vindruvor, paprika, sparris, lök, broccoli, schalottenlök, körsbär, te och tomater. Quercetin finns också i medicinalväxter, såsom Ginkgo biloba.
Quercetin uppvisar antivirala, antibakteriella, antiinflammatoriska såväl som anticarcinogena effekter. De anticarcinogena effekterna förmedlas genom flera mekanismer, såsom att rikta in sig på fria radikaler, inducera apoptos, reglera cellcykeln och rikta in sig på viktiga nyckelmolekyler i cancerutveckling.
- Quercetins antioxidanteffekter skyddar celler från effekterna av ROS och RNS (fria radikaler), som bidrar till cancerutveckling. Dessutom bidrar quercetin till minskningen av ROS-inducerad skada genom att öka uttrycket av antioxidantenzymer.
- Quercetin inducerar apoptos (celldöd) i cancerceller via både mitokondriella effekter och epigenetik.
- Quercetin hämmar PI3K/AKT/mTOR- och STAT3-“vägar”
- Quercetin minskar också inflammation genom minskad frisättning av IL-6- och IL-10-cytokiner och ökad ferritinnedbrytning
- Quercetin inducerar cellcykelstopp
- Dessutom har quercetin visat sig hämma en viktig nyckelmolekyl, VEGF, som spelar en betydande roll för endotelcellers överlevnad och kan orsaka tumörangiogenes (blodkärlsbildning).
- Quercetintillskott har i studier visat sig kunna normalisera följande faktorer som är involverade i cancerutveckling: insulinliknande tillväxtfaktorreceptor 1 (IGFIR), AKT, androgenreceptor (AR) och cellproliferationsproteiner
- Quercetin kan även hjälpa till att minska invasionen, vidhäftningen, proliferationen och migrationshastigheten hos metastaserande celler
- Kliniska studier har också visat att quercetin inte har någon toxicitet eller negativa effekter
- Quercetin har i kliniska visat sig (förutom bl.a. antiinflammations- och antitumöregenskaper) kunna lindra anemi och sänka blodtrycket
4. EGCG (grönt te)
EGCG, epigallocatechin gallate, är en naturlig flavonoid under underklassen falvan-3-oler (katekiner). EGCG kan hittas i kakaobaserade produkter, nötter och vissa frukter, men grönt te anses vara huvudkällan
EGCG anses vara det vanligaste och mest terapeutiska aktiva katekinet i grönt te (de andra tre katekinerna är epicatechin (EC), epigallocatechin (EGC) och epicatechin gallate (ECG)).
EGCG är mycket effektiv mot fria radikaler och den uppvisar sin antioxidanteffekt genom flera mekanismer; och det har effekt mot cancer, diabetes, fetma, kardiovaskulära, neurodegenerativa och metabola sjukdomar. EGCG har även antivirala, antibakteriella och antiinflammatoriska egenskaper.
Som en anticancerprodukt uppvisar EGCG sin verkan genom flera mekanismer, såsom att påverka redoxreaktioner och inducera apoptos och cellcykelarrest, försämra vissa proteiner och faktorer som har en roll i cancerutveckling, hämma angiogenes (blodkärlsbildning), fungera som ett metallkelatmedel, stabilisera p53 i dess antitumöraktivitet och påverkar cellproliferation.
5. Allicin (vitlök)
Allicin är en svavelinnehållande flyktig olja som produceras av växten genom vävnadsskada av alliin – framförallt i vitlök, men även annan lök. Allicin finns inte medan vitlöken är intakt; den aktiveras genom att hacka, pressa eller skära vitlöksklyftorna. Mer: https://4health.se/darfor-ska-du-pressa-vitlok-vitlokens-halsoeffekt
Allicin har egenskaper som anticancer, svampdödande och antibakteriell , och även mot kardiovaskulära sjukdomar (CVD), bl.a. eftersom det vidgar blodkärl (men också pga flera andra effekter)
När det gäller cancer har allicin effekter på grund av många mekanismer, såsom inducering av apoptos (celldöd) och undertryckande av migration och invasion av cancerceller, vilket har synergistiska effekter med cancerbehandlingar. Allicin bidrar bl.a. till autofagiberoende celldöd via flera mekanismer.
6. Thymoquinone, TQ (svartkummin)
Tymokinon (TQ) är en icke-toxisk bioaktiv ingrediens i den eteriska oljan av svartfrö (Nigella sativa L.) Det har använts i stor utsträckning i traditionell medicin i Mellanöstern och Sydostasien på grund av dess många biologiska effekter. Tillämpningar inkluderar behandling av många sjukdomar, inklusive diabetes och cancer.
TQ:s effekter inkluderar antioxidant, antiinflammatorisk, immunmodulerande, leverskyddande, antihistamin, antimikrobiell, antidiabetisk, antiepileptisk och kemosensibiliserande verkan, såväl som mycket lovande antitumöraktivitet.
TQ-anticancerstudier har visat på flera verkningsmekanismer, såsom reglering av reaktiva ämnen som stör DNA-strukturen, modulering av olika signalvägar samt inducering av immunsvar.
Anticanceregenskaperna hos TQ beror främst på induktionen av apoptotiska mekanismer (celldöd), nedreglering av precancerösa gener, antitumör cellproliferation, hypoxi, antimetastaser och minskning av biverkningar vid användning av traditionella kemoterapeutiska läkemedel.
TQ förhindrar DNA-skador orsakade av fria radikaler genom att rensa fria radikalers aktivitet. TQ verkar förebyggande mot tumörer genom aktivering av antioxidantenzymer och dess antioxidantaktivitet.
7. Emodin (Kinesiska örter, aloe vera och medicinalsvamp)
Emodin finns i kinesiska örter såsom i rötter och rhizomer från växter som Rheum palmatum, Polygonum cuspidatum, Polygonum multiflorum, Aloe vera och Cassia obtusifolia, samt olika svamparter, inklusive Aspergillus ochraceus och Aspergillus wentii.
Emodin uppvisar en mängd olika farmakologiska aktiviteter, såsom antivirala, antibakteriella, anti-allergiska, anti-osteoporotiska, antidiabetiska, immunsuppressiva, neuroprotektiva, leverskyddande, anti-kardiovaskulära sjukdomar, antitumörer och antiinflammatoriska.
De molekylära mekanismerna för emodin inkluderar cellcykelarrest och apoptos; det hämmar angiogenes, invasion, migration, kemiskt inducerad carcinogen-DNA-adduktbildning mm
8. Genistein (sojabönor)
Genistein klassificeras som ett fytoöstrogen. Det finns särskilt i baljväxter. Det liknar strukturellt 17β-östradiol, vilket är orsaken till dess förmåga att binda till och modulera aktiviteten hos östrogenreceptorer. Den isolerades för första gången år 1899 från Genista tinctoria; därför fick den sitt namn efter släktet av denna växt. Det är dock den huvudsakliga sekundära metaboliten av Trifolium-arterna och i Glycine max (sojaböna). Sojabönor är bästa källan till genistein. Lupin (Lupinus perennis) är också en baljväxt som har liknande näringsvärde som sojabönor vad gäller genisteinhalt. Andra viktiga baljväxter är bondbönor och kikärter, som är kända för att innehålla betydande mängder genistein, men mindre än sojabönor och lupin. Genistein fungerar farmakologiskt som ett anticancer-, östrogen- och anti-osteoporotiskt medel.
Genistein utövar sina anticancereffekter genom att inducera apoptos (celldöd), minska proliferation (spridning) och hämma angiogenes (blodkärlsbildning), såväl som metastaser.
Genistein är involverat i reglering av viktiga biologiska processer inklusive de i olika typer av cancer via epigenetisk modulering på ett direkt eller indirekt sätt genom östrogenreceptorberoende vägar, där det rapporteras rikta in sig bl.a. på östrogenreceptor (ER) och andra receptorer av betydelse i cancerutveckling, men har också många andra effekter mot cancer som du kan läsa mer om i artikeln som du hittar via länken längre ner.
Dessutom vänder detta fytonäringsämne synergistiskt resistensmekanismen för vanliga kemoterapeutiska läkemedel, vilket ökar deras effektivitet mot bröstcancer.
9. Parthenolide, PTL (prästkrage, magnolia och feberblomma)
Parthenolide (PTL) är ett naturlig ämne i form av en sekundär metabolit av växter från familjen Asteraceae/Compositae (prästkragar) och Magnoliaceae (magnolior) . Den utvinns ur bladen från medicinalväxten feberblomma (Tanacetum parthenium).
PTL har redoxmodulerande, epigenetiska, antiinflammatoriska och antibakteriella biologiska aktiviteter. Dess användning vid behandling av migrän och artrit har bekräftats i forskning. Dessutom har PTL visat potent anticanceraktivitet mot olika typer av cancer, inklusive kolorektal cancer, bukspottkörtelcancer, lungcancer, hudcancer, melanom, cancer i urinblåsa och bröstcancer. Parthenolide är inte bara ett kraftfullt anticancerläkemedel; det har inte heller någon märkbar toxicitet för normala celler vid den cytotoxiska effektiva koncentrationen.
En av flera mekanismerna som ligger bakom PTL:s antitumöraktivitet är dess förmåga att stimulera apoptos (celldöd) genom hämning av NF-κB “pathways”. Detta är något som spelar en viktig roll i uttrycket av pro-inflammatoriska gener, inklusive gener för cytokiner mm. Men det finns flera andra sätt på vilka PTL kan inducera apoptos.
10. Luteolin (örter och grönsaker – bl.a. persilja, pepparmynta, oregano, timjan och selleri)
Luteolin är en flavonförening som tillhör flavonoidgruppen. Det finns i blommor som Reseda luteola och krysantemum; i örter som persilja, pepparmynta, oregano och timjan; i grönsaker såsom i sellerifrö, lökblad, kål, paprika, morötter och broccoli; och i kryddor som kardemumma och anis.
Luteolin har flera skyddande effekter mot hjärt- och kärlsjukdom, såväl som antimikrobiella, antiinflammatoriska, antioxidanta och anticancereffekter. Dessutom uppvisar luteolin anticanceraktivitet mot tjocktarms-, lever-, lung-, hud- och bröstcancer.
Luteolin har visat sig vara säkert för normala, friska celler.
Luteolin uppvisar sina anticanceregenskaper genom olika mekanismer, inklusive påverkan via epigenetik. Det inducerar också autofagi (“cellstädning”) och cellapoptos (celldöd) och hämmar invasion, nätverksbildning och migration.
Luteolin och quercetin kan synergistiskt förstärka anticancereffekten av cancerläkemedel.
Den nya vetenskapliga artikeln
I den nypublicerade artikeln skriver man, förutom mer om ovan, bl.a. om att:
- Konventionella cancerbehandlingar är förknippade med bristande selektivitet och allvarliga biverkningar.
- Så kallade “cancer hallmarks” är biologiska egenskaper som cancerceller får (genom sk neoplastisk transformation). Att rikta in sig på flera sådana “hallmarks” (cancerkännetecken) är en lovande strategi för att behandla cancer.
- Mångfalden i kemisk struktur och den relativt låga toxiciteten gör växtbaserade naturliga produkter till en lovande källa för utveckling av nya och mer effektiva anticancerterapier som har kapacitet att rikta in sig på flera sådana “hallmarks” i cancer.
- I den här artikeln diskuteras anticanceraktiviteterna hos tio naturliga ämnen utvunna från växter. Majoriteten av dessa produkter hämmar cancer genom att rikta in sig på flera hallmarks/cancerkännetecken, och många av dessa kemikalier har nått kliniska tillämpningar.
- Studier som diskuteras i denna vetenskapliga översikt ger en solid grund för forskare och läkare att utforma effektivare kombinationsbehandlingar mot cancer med växtbaserade naturliga produkter.
Tidigare om cancer via taggen: https://4health.se/tag/cancer och specifikt om växtämnen mot cancer bl.a. här: https://4health.se/orter-och-kryddor-mot-cancer
https://www.mdpi.com/1420-3049/27/15/4818/htm
Cancer hallmarks / cancerkännetecken (lista)
- VEGF, vascular endothelial growth factor;
- VEGFR, vascular endothelial growth factor receptor;
- EGF, epidermal growth factor;
- hepatocyte growth factor;
- ATM, ataxia-telangiectasia mutated;
- PTEN, phosphatase and tensin homolog;
- APC, adenomatous polyposis coli;
- BRCA1 and BRCA2, breast cancer gene 1 and 2;
- RB, retinoblastoma;
- WT1, Wilms tumor;
- CDKs, cyclin-dependent kinase;
- IGF-1R, insulin-like growth factor receptor;
- HIF-1, hypoxia-inducible factor-1;
- HK2, hexokinase 2;
- PKM2, pyruvate kinase isoform M2;
- PFKFB3, 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3;
- PD-L1, programmed death ligand 1;
- MHC, major histocompatibility complex;
- CD8, cluster of differentiation 8
Mer om “cancer hallmarks” – särskilda egenskaper hos cancerceller
Cancer hallmarks are biological capabilities that are acquired during neoplastic transformation and help in organizing the complexity of cancer development. Many natural products exert their anticancer effect through targeting one or multiple cancer hallmarks.
2.1. Genomic Instability
Genomic instability is a property of many tumor cells that can be triggered by different mechanisms such as telomerase destruction, centrosome amplification, epigenetic modifications, and DNA impairment [14]. In a normal cell cycle, the integrity of the genome is controlled by specific checkpoints and any abnormality in function of these checkpoints can lead to development of tumorigenesis [15,16]. These checkpoints are regulated by different oncogenes and tumor suppressor genes; nevertheless, cancer cells can modify the functions of these genes resulting in stimulation of uncontrolled cell growth [16].
2.2. Sustained Proliferative Signaling
Modulating the expression of growth-promoting signals is a prominent feature of cancer cells in order to maintain their uncontrolled cell division and proliferation [17]. The essential targets to inhibit sustained proliferation in cancer include the following signaling pathways: hypoxia-inducible factor-1 (HIF-1), NF-κBs, PI3K/AKT, insulin-like growth factor receptor (IGF-1R), cyclin-dependent kinase (CDKs), and estrogen receptor signaling [18].
2.3. Evasion of Anti-Growth Signaling
The evasion of antigrowth signals is another strategy implemented by cancer cells to preserve proliferation. Blocking tumor suppressor genes that regulat the antigrowth signals, as well as mutations in these genes, have been detected in cancer cells [16]. In addition, the most identified mutated tumor suppressor genes is p53 followed by ataxia-telangiectasia mutated (ATM), cyclin-dependent kinase inhibitor 2A (CDKN2A), phosphatase and tensin homolog (PTEN), adenomatous polyposis coli (APC), breast cancer gene 1 and 2 (BRCA1 and BRCA2), retinoblastoma (RB), and Wilms tumor (WT1) [18].
2.4. Resistance to Apoptosis
Cancer cells can promote the overexpression of anti-apoptotic proteins eventually suppressing the normal programmed cell death [17]. Moreover, cancer cells can limit or bypass apoptosis via many pathways such as altering the function of p53 tumor suppressor gene, increasing the expression of antiapoptotic regulators (Bcl-2 and Bcl-xL), promoting survival signals (Igf1/2), reducing the levels of proapoptotic factors (Bax, Bim, Puma), and suppressing the signals of the extrinsic ligand-induced death pathway [17].
2.5. Replicative Immortality
Cancer cells are recognized for their limitless replicative potential, which mediates tumor progression and invasion. Telomerase is a specialized reverse transcriptase that extends the ends of shortening chromosomes in dividing cells [16,19]; hence, activation of this enzyme is the key to maintain continuous cell division in many types of cancer [17]. In addition, replicative immortality can be modulated by suppressing many targets including telomerase, mTOR, CDK4/6, CDK 1,2,5,9, Akt, and PI3K [18].
2.6. Dysregulated Metabolism
Altering energy metabolism has been confirmed to be a cancer-associated trait, which involves the stimulation of many oncogenes and mutated suppressor genes [17]. In order to increase glucose uptake and lactate production, several glycolytic enzymes are activated, including hexokinase 2 (HK2), 6-phosphofructo-2-kinase/fructose-2,6-biphosphatase 3 (PFKFB3), and pyruvate kinase isoform M2 (PKM2) [16]. In addition, overexpression of other metabolic regulators such as hypoxia-inducible factor 1 (HIF-1) and Myc oncogene was observed in cancer cells [20,21].
2.7. Tumor-Promoting Inflammation
A specific association between chronic inflammation and cancer development has been observed [22,23]. Furthermore, several factors have been identified for their crucial role in stimulating cancer-related inflammation, including cytokines (interleukins, TNF-α, TGF-β, and granulocyte macrophage colony-stimulating factor), chemokines, and transcription factors (NF-kB, STAT3, HIF-1-α) [22].
2.8. Angiogenesis
During the malignancy stage, an “angiogenic switch” is triggered in tumor cells, which involves stimulation of angiogenic factors that mediate vascularization (blood vessels formation) [24]. These new growing blood vessels would supply the dividing cancer cells with oxygen and nutrients, which are essential to sustain cell proliferation [24]. This angiogenesis process is regulated by many transmembrane proteins and pathways, including vascular endothelial growth factor (VEGF), VEGF receptor 2 (VEGFR2), Tie-angiopoietin pathways, platelet-derived growth factor (PDGF), epidermal growth factor (EGF), and hepatocyte growth factor (HGF) [24,25].
2.9. Tissue Invasion and Metastasis
Cancer metastasis is a multi-step process that starts with local invasion of cancer cells into the surrounding tissues. The next step is intravasation into the nearby vessels, extravasation to distant tissues and organs, and finally adaptation to a new microenvironment during which micro-metastases will progress into a secondary tumor [17]. Tumor cell metastasis is known to be initiated by the disruption of cell–cell adhesion, which is comprised of tight junctions, adherens junctions, gap junctions, desmosomes, and hemidesmosomes [26].
2.10. Immune Evasion
Cancer cells apply different strategies to evade immune surveillance. These include modulating immune checkpoint pathways and recruiting immunosuppressive cells (e.g. regulatory T cells and myeloid-derived suppressor cells). Additional mechanisms involve impairing some elements of the immune system (e.g. suppressing infiltrating CTLs and NK cells by overexpression of TGF-β or other immunosuppressive factors) [17]. Figure 1 summarizes the cancer hallmarks with the main regulating markers.
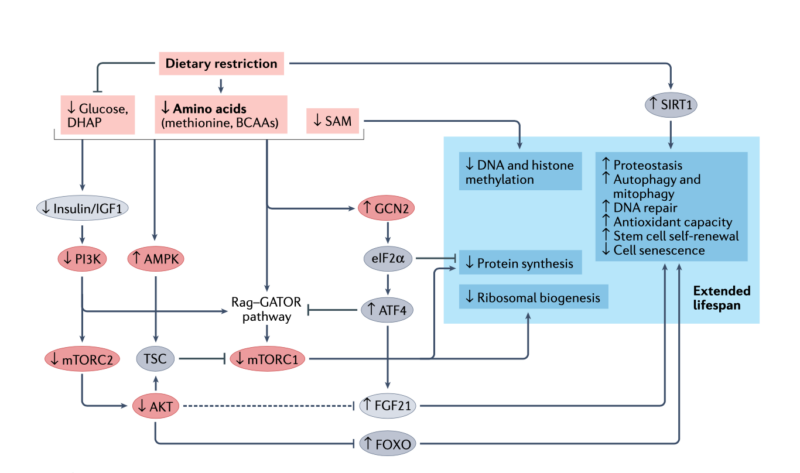
Mekanismer i kroppen vid fasta som förbättrar livslängd och hälsa
Kostrestriktion (dvs att underäta / kalorirestriktion) är enligt forskning “Golden standard” för att förlänga livet. Fasta har liknande effekter, liksom begränsning av aminosyran metionin samt grenade aminosyror (vi pratar en del bl.a. om metioninrestriktion och fasta vid cancer i podcastavsnitt 272: https://4health.se/272-bekampa-cancer-ida-johnssons-resa-fran-stadium-iv-cancer )
Det som händer i kroppen är att detta påverkar metabola processer och epigenetik. Bl.a. påverkas mTor, FOXO (lyssna mer ang detta i podcastavsnitten med Dr Marcus Gitterle), AMPK, AKT, NAD+, FGF21 och SIRT – alla dessa är involverade i livslängd och hälsa.
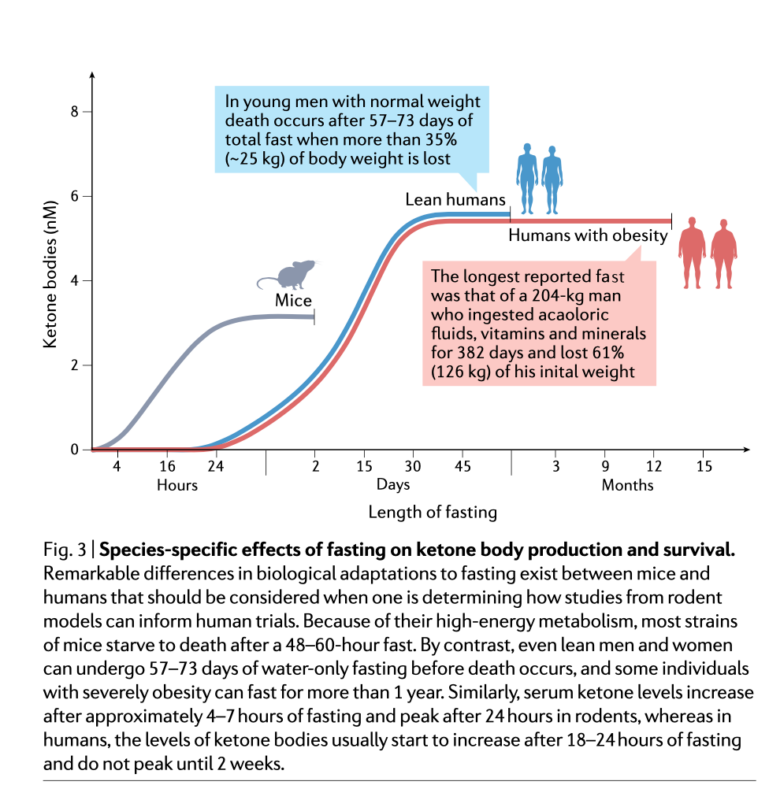
Via länken nedan finns en riktigt bra artikel som beskriver dessa kopplingar. Hoppas att ni kan läsa hela, det är en länk som ska dela en betalartikel, men vet inte om det finns begränsningar på hur många som kan använda länken… Men se även illustrationerna från artikeln här i inlägget.
Fetma blockerar immunförsvarets cancer-bekämpare
 Att det finns ett samband mellan övervikt och cancer är ingen nyhet. Och det är lätt att tänka att det beror på att liknande mekanismer är involverade i båda fallen, såsom ett högt blodsocker och insulin, vilket både ger övervikt och kan fungera som bensin på cancertillväxt.
Att det finns ett samband mellan övervikt och cancer är ingen nyhet. Och det är lätt att tänka att det beror på att liknande mekanismer är involverade i båda fallen, såsom ett högt blodsocker och insulin, vilket både ger övervikt och kan fungera som bensin på cancertillväxt.
Men det är nog mer invecklat än så, och framförallt är det fler mekanismer involverade. Ny forskning visar att i närvaro av överflödigt fett så misslyckas immunövervakningssystemet på grund av en lipidackumulering i NK-celler (natural killer cells). vilket förhindrar deras metabolism och framfart.
NK-celler är celler från det medfödda icke-specifika immunsystemet som begränsar tumörernas spridning. Många in vitro-modeller har visat att tumörcellerna känns igen som “mål” av NK-celler. NK-celler kräver en stor mängd energi för att deras anti-tumöraktivitet ska fungera, därför byter de sin metaboliska aktivitet från oxidativ fosforylering (OXPHOS) till glykolys för att möta den ökade efterfrågan på ATP.
Forskarna upptäckte att NK-celler vid fetma visar ökad lipidackumulering, vilket resulterar i “metabolisk förlamning”. Detta leder till förlust av anti-tumöraktiviteten både in vitro och in vivo-modeller (dvs både i labb och i djur/människor).
Ur studien:
“Up to 49% of certain types of cancer are attributed to obesity, and potential mechanisms include overproduction of hormones, adipokines, and insulin. Cytotoxic immune cells, including natural killer (NK) cells and CD8+ T cells, are important in tumor surveillance, but little is known about the impact of obesity on immunosurveillance. Here, we show that obesity induces robust peroxisome proliferator-activated receptor (PPAR)-driven lipid accumulation in NK cells, causing complete ‘paralysis’ of their cellular metabolism and trafficking. Fatty acid administration, and PPARα and PPARδ (PPARα/δ) agonists, mimicked obesity and inhibited mechanistic target of rapamycin (mTOR)-mediated glycolysis. This prevented trafficking of the cytotoxic machinery to the NK cell–tumor synapse. Inhibiting PPARα/δ or blocking the transport of lipids into mitochondria reversed NK cell metabolic paralysis and restored cytotoxicity. In vivo, NK cells had blunted antitumor responses and failed to reduce tumor growth in obesity. Our results demonstrate that the lipotoxic obese environment impairs immunosurveillance and suggest that metabolic reprogramming of NK cells may improve cancer outcomes in obesity.”
Mer än 1,9 miljarder vuxna är överviktiga eller feta och en växande mängd bevis visar att många cancerformer är vanligare hos feta eller överviktiga personer. Cancerrisken ökad med upp till 49% av vissa typer av fetma..
NAC, epigenetik, oxidativ stress och glutation
Fortsätter att följa upp podcastavsnittet med Dr Marcus Gitterle med lite extra tips.
Epigenetik
Epigenetik är vår förmåga att slå på och av gener. Trots att vi föds med en uppsättning gener påverkas vi mer av om generna är aktiverade eller tystade. Och detta kan vi i sin tur påverka med vår livsstil.
mTOR har jag skrivit och pratat om tidigare. (sök https://4health.se/?s=mtor)
Vi vill hålla den avslagen/nedreglerad en stor del av tiden. mTOR-uppreglering leder till en kaskad av effekter som också har en åldrandeeffekt. Celler agerar som gamla när mTOR är överaktiverad.
mTOR har samband med cancer och det nedreglerar autofagi. Autofagi kan du läsa mer om i tidigare inlägg här på 4health.se, men det är återvinning av gamla dåliga komponenter i cellen.
mTOR har en stark koppling till insulin. Och sätt att hålla mTOR nedreglerad är bl.a. saker som håller insulinet i schack. Träning i form av styrketräning och intervallträning, och en ketogen kost tex. Både kolhydrater och proteiner i överflöd kan ha en negativ effekt och uppreglera mTOR.
I avsnitt 23 av podcasten pratar vi om carb cycling och cyklisk ketos, vilket kan ge en hälsosam mTOR cycling.
När FOXO är uppreglerad så uppregleras helande funktioner i cellen, allt börjar repareras. Autofagi uppreglas, och det uppreglerar också immunsystemet.
Det finns många sätt att aktivera FOXO, bland annat genom att äta en bra lågkolhydratkost, och gärna även periodisk fasta. Träning är ett annat sätt att uppreglera FOXO. Dessutom kan man använda sig av tillskott av NAC, vilket både tystar ner mTOR och aktiverar FOXO.
NAC, N-acetyl-cystein, är en aminosyra som man kan ta som tillskott.
Oxidativ stress och glutation
När vi pratar oxidation, oxidering eller oxidativ stress, så pratar vi fria radikaler. En fri radikal är en atom eller molekyl som har oparade elektroner. Detta gör fria radikaler mycket reaktiva, så att de gärna bildar nya kemiska föreningar. Fria radikaler bildas i helt vanliga reaktioner i vår kropp, inte minst vid energiproduktion i cellerna.
De fria radikalerna kan skada proteiner och lipider i cellerna, vilket bildar skadade molekyler som cellen måste ta hand om, vilket i sin tar tar energi som skulle använts till andra saker. Det finns dessutom en direkt korrelation med sjukdom. Ju mer oxidativ skada, ju mer kronisk sjukdom.
Vi har ett kroppseget inbyggt sätt att hantera fria radikaler, bl.a. vårt mycket viktiga glutation. Vi kan få i oss antioxidanter från maten, allt från C-vitamin till färgämnen i grönsaker. Men vårt kroppsegna försvar är så mycket mer effektivt. Så trots att C-vitamin mm är viktigt, så är det mer effektivt att arbeta med att höja glutation. Att ta en av glutations byggstenar NAC är ett mycket bra sätt att öka glution på. En annan viktig byggsten är glycin. Båda kan man ta som tillskott.
På bilden ser du ett exempel på en NAC-produkt.
Vårt överdrivna proteinfokus
 Protein är byggstenar som behövs för att bygga celler, enzymer och hormoner. Men kroppen återvinner mycket protein och vi behöver därför inte äta så mycket. Ett för stort intag av protein kan snarare bli ett problem eftersom överskottet omvandlas till blodsocker och har visat sig påverka mTor och annat spännande, som du kan läsa mer om i den serie inlägg jag gjorde för några år sen, eller lyssna på i ett podcastavsnitt. Här hittar du det: https://4health.se/avsnitt-16-bor-du-minska-pa-proteinet-och-lite-om-fettdrift-vs-sockerdrift och läs även via taggen protein
Protein är byggstenar som behövs för att bygga celler, enzymer och hormoner. Men kroppen återvinner mycket protein och vi behöver därför inte äta så mycket. Ett för stort intag av protein kan snarare bli ett problem eftersom överskottet omvandlas till blodsocker och har visat sig påverka mTor och annat spännande, som du kan läsa mer om i den serie inlägg jag gjorde för några år sen, eller lyssna på i ett podcastavsnitt. Här hittar du det: https://4health.se/avsnitt-16-bor-du-minska-pa-proteinet-och-lite-om-fettdrift-vs-sockerdrift och läs även via taggen protein
Nu rapporterar även SVT:s konsumentmagasin Plus om detta. De säger att trots att vi svenskar med god marginal får i oss tillräckligt med protein marknadsförs många produkter med att de ger ett extra proteintillskott.
Livsmedelsverket rekommenderar att 10 till 20 procent av kalorierna som en vuxen person upp till 65 år äter ska komma från protein. Det motsvarar mellan 50 och 100 gram protein per dag. Vilket stämmer väl överens med beräkningen 0,75-1 g protein per kilo kroppsvikt (upp till 1,5 g per kilo kroppsvikt om vi tränar hårt etc)
I snitt får svenska kvinnor i sig 72 gram protein per dag. För män är den siffran 92. Men trots att vi alltså får i oss tillräckligt med protein så råder det just nu en stor hype kring proteinberikade produkter.
Det finns ett stort önskemål från konsumenter, och livsmedelsföretagen är inte sena att haka på. Men i stort sett alla får i sig det de behöver via kosten. Undantagen kan vara de med magproblem som inte tar upp aminosyror som de ska, samt veganer.
Trots detta marknadsförs många produkter med att de innehåller extra mycket protein. Och bönderna gör allt för att höja proteininnehållet (gluten alltså) i mjölet.
Plus undersökning visade bl.a. att det i Coops större butiker finns över 200 produkter där proteinmängden lyfts fram på förpackningen.
http://www.svt.se/nyheter/vetenskap/vi-behover-inte-proteinberikade-produkter-1
Därför kan kaffe ge skydd mot bröstcancer – så funkar det
 För en dryg vecka sen meddelade de flesta medier att kaffe kan skydda mot bröstcancer. Fick frågor från er läsare om mina tankar kring detta samma dag som nyheten om studien kom, och besvarade kort här i kommentarerna till ett äldre inlägg https://4health.se/kaffedrickande-genetiskt#comment-14553
För en dryg vecka sen meddelade de flesta medier att kaffe kan skydda mot bröstcancer. Fick frågor från er läsare om mina tankar kring detta samma dag som nyheten om studien kom, och besvarade kort här i kommentarerna till ett äldre inlägg https://4health.se/kaffedrickande-genetiskt#comment-14553
Jag ska beskriva den nya studien och sen lägga fram några möjliga förklaringar till resultatet av kaffe på bröstcancer
Det är alltså ny forskning i Lund som visar att kaffe skyddar mot återfall i bröstcancer. Studien visar dels att de som drack minst två koppar kaffe om dagen hade mindre tumörer och lägre andel hormonberoende tumörer. Och flera forskningsstudier har tidigare visat att kaffe har en skyddande effekt mot bröstcancer.
För dem som kombinerade läkemedlemedelsbehandling med tamoxifen med kaffe minskade risken för återfall i bröstcancer påtagligt.
Den andra delen av det här är att forskarna har tittat närmare på koffein och koffeinsyra i en cellstudie. Bröstcancercellerna reagerade på de här ämnena med minskad celldelning och en ökad celldöd, särskilt i kombination med tamoxifen.
Så då kommer vi till mina kommentarer.
Några möjliga anledningar till resultaten:
- mTOR
Koffeinet i kaffe kan hämma mTOR. Som jag skrivit tidigare ang mTOR: “har mTOR visat sig påverka bl.a. fortplantningsförmåga, åldrande och risk för degeneration sjukdomar och cancer”…“Att hålla mTOR nedreglerad”…” är en nyckel för att maximera kroppens underhåll, immunfunktion mm. Vilket kan förlänga livslängden och minska åldrandeprocessen.” Läs mer om vad mTOR är här https://4health.se/minska-protein-del-2-om-amnesomsattningsprocesser-och-cancer, eller lyssna på podcastavsnittet om protein https://4health.se/avsnitt-16-bor-du-minska-pa-proteinet-och-lite-om-fettdrift-vs-sockerdrift. Här är exempel på studie av koffein relaterat till mTOR: http://www.jbc.org/content/281/42/31616.long “a number of other pharmacological agents have been shown to affect TOR, particularly in mammalian cells, including members of the methylxanthine family of compounds such as caffeine (25-27). Caffeine affects a diverse array of cellular processes related to cell growth, DNA metabolism, and cell cycle progression, most likely by acting as a low affinity ATP analog (28, 29). Both caffeine and the related compound theophylline have been shown to inhibit phosphorylation of mTOR-dependent substrates both in vitro as well as in vivo (25-27).” - CYP1A2
CYP1A2 är ett enzym i levern som bryter ner olika sorters läkemedel och koffein, men som också påverkar och bryter ner hormoner, tex sömnhormonet melatonin. Bröstcancer är en starkt hormonrelaterad sjukdom. En tanke är att koffeinet ökar aktiviteten hos enzymet CYP1A2, och att koffeinet därmed har en hormonell påverkan som kan minska bröstcancer. Den här hypotesen är troligen något långsökt dock. - Växtgifter
Koffein är ett växtgift. Växtgifter generellt är giftigare för cancerceller än vanliga celler. Ta broccoli som exempel. Ämnet sulforafan i broccoli har visat sig ta död på cancerstamceller och motverka ny tumörtillväxt. Sulforafan är ett växtgift som broccolin utsöndrar för att skydda sig från att bli uppäten. Det är en anledning till att grönsaker är extra viktigt om man drabbas av cancer, särskilt sådana med högt innehåll av växtgifter som bönor. Så möjligen har koffeinet en direkt verkan på cancerceller.
Med detta sagt rekommendrar jag inte koffein för att förebygga cancer. Koffein är ett gift. Man kan dricka en eller två koppar kaffe för att man tycker om det utan att ta skada. Men nedreglering av de här processerna, proteinerna och enzymerna jag nämnt ovan ska inte behövas på det här sättet. Anledningen att de går på overdrive är relaterat till högt blodsocker och insulin, eller möjligen överkonsumtion av protein. Så om vi äter som vi är gjorda för, och gärna fastar kort ibland, så håller vi detta i schack. I kombination med att inte få i oss fytoöstrogener från sojaprodukter, hormoner från preventivpiller och hormonstörande gifter. Det är såklart annorlunda om man redan har drabbats av bröstcancer. Det är klart att man då vid sidan av kost och andra saker dessutom kan testa kaffe.
Läs gärna tidigare inlägg om cancer här https://4health.se/tag/cancer
Den nya studien kan du läsa om här
http://www.svt.se/nyheter/regionalt/skane/kaffe-skyddar-mot-aterfall-i-brostcancer









Senaste kommentarer