 Forskare betonar att om vi hittar ett tillstånd som kallas flow kan vi minska stress och bli mer harmoniska. Flow skapas genom bland annat dans, musik och kultur.
Forskare betonar att om vi hittar ett tillstånd som kallas flow kan vi minska stress och bli mer harmoniska. Flow skapas genom bland annat dans, musik och kultur.
Har du någongång upplevt att du är så koncentrerad, så inne i ett ämne att både tid och rum försvinner? Att du är djupt fokuserad men samtidigt så avslappnad att tillståndet inte tar någon mental energi för att upprätthålla? Det är det här som kallas för flow.
Var femte sjukskrivning beror på stress och utmattning. Nu visar en studie att mer flow i livet skulle kunna minska på stressen. Forskarna har i sin studie sett att personer som upplever mer flow i livet rapporterar mindre problem med depressiva symptom och mindre problem med utbrändhet. Om vi kan hitta flow, skulle vi klara av stress bättre.
Det finns ett visst genetiskt bidrag till hur lätt man hittar flow säger en av forskarna, men mer signifikanta bidrag beror på närmiljön. Det är känt sedan länge att särskilt dans och musik, men även andra kulturella upplevelser, är flowskapande. Man har visat att ett deltagande i dessa aktiviteter också leder till sänkta stressnivåer.
https://sverigesradio.se/sida/artikel.aspx?programid=406&artikel=7290336

 Förmågan att äta sig fet, sova sig igenom långa vintrar och ändå hålla sig frisk är något som björnen klarar och som intresserar forskare. Man har hittat ämnen i björnblodet som visat sig kunna stimulera mänskliga muskelceller – och kanske bli nya läkemedel.
Förmågan att äta sig fet, sova sig igenom långa vintrar och ändå hålla sig frisk är något som björnen klarar och som intresserar forskare. Man har hittat ämnen i björnblodet som visat sig kunna stimulera mänskliga muskelceller – och kanske bli nya läkemedel. Överanvändning av antibiotika har gjort att bakterierna börjar bli resistenta. Tio miljoner människor kan dö varje år om inga nya läkemedel utvecklas.
Överanvändning av antibiotika har gjort att bakterierna börjar bli resistenta. Tio miljoner människor kan dö varje år om inga nya läkemedel utvecklas. Dr David Brady berättar om mycket spännande kopplingar mellan specifika bakterier i dina tarmar och olika sjukdomar.
Dr David Brady berättar om mycket spännande kopplingar mellan specifika bakterier i dina tarmar och olika sjukdomar. Längesen jag la ut nyttiga onyttigheter 🙂 Så det är väl dags. Även om du inte äter ersättarna själv så är det bra att ha recept till hands när barnen ber om pizza. Just det här receptet blir väldigt bra/ likt “vanlig” pizza, men det finns många varianter – se tidigare recept på pizza
Längesen jag la ut nyttiga onyttigheter 🙂 Så det är väl dags. Även om du inte äter ersättarna själv så är det bra att ha recept till hands när barnen ber om pizza. Just det här receptet blir väldigt bra/ likt “vanlig” pizza, men det finns många varianter – se tidigare recept på pizza  Har du också gått på kost-hypen?
Har du också gått på kost-hypen? Antibiotikaförsäljningen till djur fortsätter att sjunka i flera europiska länder, enligt en rapport från den Europeiska läkemedelsmyndigheten.
Antibiotikaförsäljningen till djur fortsätter att sjunka i flera europiska länder, enligt en rapport från den Europeiska läkemedelsmyndigheten.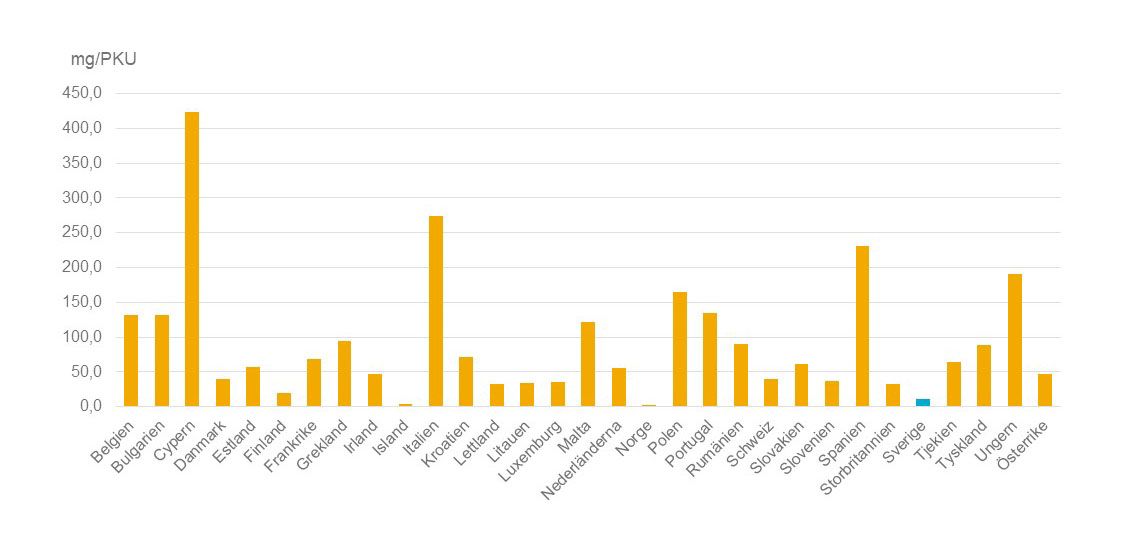
 Fysiologi – älska det! Hur kroppen fungerar 🙂
Fysiologi – älska det! Hur kroppen fungerar 🙂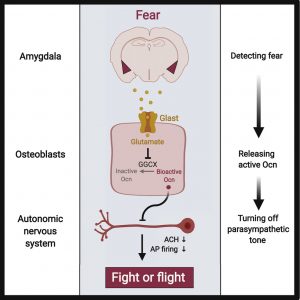 Skelettet har inte bara en stödjande, strukturell och skyddande funktion i kroppen. Det kan även reagera på stressiga eller hotfulla situationer, visar ny forskning. Detta genom att skelettet bildar ett hormon vid stress som verkar vara viktigare än adrenalin!
Skelettet har inte bara en stödjande, strukturell och skyddande funktion i kroppen. Det kan även reagera på stressiga eller hotfulla situationer, visar ny forskning. Detta genom att skelettet bildar ett hormon vid stress som verkar vara viktigare än adrenalin! Rörelse och/eller löpning som återhämtning! Hur kan rörelse och träning ge dig återhämtning?! Hur kan du springa och återhämta dig samtidigt?
Rörelse och/eller löpning som återhämtning! Hur kan rörelse och träning ge dig återhämtning?! Hur kan du springa och återhämta dig samtidigt?
Senaste kommentarer